Embriotransfer – zarodek w stadium podziałów czy blastocysta? 3. dzień vs. 5. dzień?
Kiedy powinno się transferować zarodek? To chyba najbardziej kontrowersyjny temat wokół in vitro. Jedni uważają, że można przenieść do macicy zarodek dwu- lub trzydniowy. Inni, że należy zaczekać do stadium blastocysty, do dnia 5. lub 6. Kto ma rację? Kiedy najlepiej przeprowadzić transfer? Postaram się przedstawić Wam różnice między transferem na etapie zarodka blastomerowego oraz blastocysty, jednak uprzedzam, że w tym temacie ciężko zachować mi obiektywizm, gdyż posiadam stanowczo ugruntowane poglądy w kierunku… Sami się przekonajcie
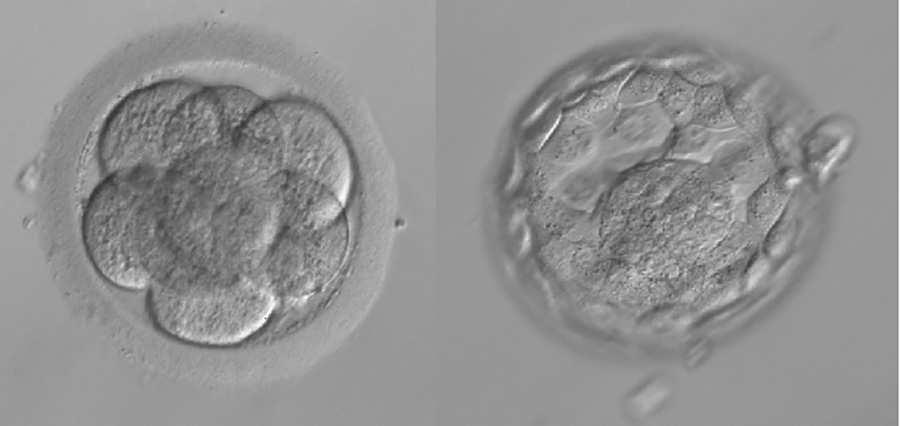
W dniu 3. zarodek składa się najczęściej z 6-8 blastomerów. W dniu 5. lub 6. zarodek osiąga stadium blastocysty.
Transfer w dniu 2. lub 3., czyli transfer zarodka złożonego z blastomerów, na etapie podziałów
Zalety:
– duża ilość dostępnych zarodków. W kolejnych dniach część z nich może zdegenerować bądź przestać się rozwijać, ale na ten moment jest ich zwykle całkiem sporo, choć to zależy od ilości pobranych komórek. Jeśli tylko komórka się zapłodniła i rozpoczęła podziały, możemy nazwać ją „zarodkiem” i w teorii nadaje się on do transferu. Ryzyko odwołania transferu jest więc bardzo niskie.
– zarodkowi jest lepiej w macicy, niż w inkubatorze. Niektórzy wierzą, że macica jest bardziej naturalnym środowiskiem do rozwoju zarodka, a więc lepiej przenieść go tam najszybciej, jak to możliwe. Istnieje niczym niepotwierdzona teoria, że niektóre zarodki nie przetrwałyby do dnia 5., ale mogłyby przetrwać, gdyby zostały podane w dniu 3. Podobnie, jeśli pacjenci mają jeden lub dwa zarodki, lekarz może zadecydować o ich podaniu w myśl zasady, że lepiej podać zarodki na nieco wcześniejszym stadium rozwoju, niż nie podać nic. Wszystkie te teorie i podejścia mogą wynikać z braku wiary w nowoczesny sprzęt, inkubatory, w których rozwijają się zarodki oraz media hodowlane zawierające substancje potrzebne do rozwoju zarodków. Środowisko w laboratorium zostało stworzone na wzór dróg rodnych kobiety: zachowana jest stabilna temperatura, minimalizujemy ilość procedur na zarodkach, dostarczamy im niezbędnych substancji energetycznych (różnych w zależności od stadium rozwoju), unikamy narażenia na światło i przechowujemy w stałych warunkach gazowych (tlen, dwutlenek węgla). Nie ma żadnych badań naukowych, które wskazywałyby na to, że inkubator lub macica są lepsze/gorsze dla pewnych zarodków i że dany zarodek ma w którymś z tych miejsc mniejsze/większe szanse. Nie mamy też technicznych możliwości, aby tego typu badania przeprowadzić.
Wady:
– nawet jeśli wybierzemy morfologicznie idealny zarodek, o równych komórkach i prawidłowych podziałach, nie mamy pewności, że zarodek nie zatrzyma się w rozwoju lub nie zdegeneruje, ze względu na wady genetyczne, których po prostu na podstawie wyglądu zarodka nie widzimy. Aneuploidii, czyli wad genetycznych w zarodkach 3-dniowych jest procentowo dużo więcej, niż w blastocystach (ponieważ jeśli zarodek jest nieprawidłowy, może do stadium blastocysty nie dotrwać). Żadne metody analizy morfologicznej nie są skuteczne w ocenie potencjału implantacyjnego zarodka na tym etapie rozwoju.
– dzień trzeci to moment KLUCZOWY w rozwoju zarodka, kiedy musi nastąpić aktywacja genomu zarodkowego. Do tej pory zarodek rozwijał się wyłącznie dzięki komórce jajowej, a od tej chwili, powinien zacząć radzić sobie już samodzielnie. Niestety, znaczna część zarodków tego etapu nie przechodzi i przestaje się rozwijać. Dzieje się tak szczególnie w przypadku męskiej niepłodności i słabej jakości plemników (ale nie tylko). To bardzo trudny dla zarodka etap, zarówno na poziomie jądrowym, jak i cytoplazmatycznym, zachodzi wiele zmian. Jest to jakby całkowite przeprogramowanie zarodka na tryb samodzielnej ekspresji genów. Pamiętacie, jak uczyliście się jeździć na rowerze? Najpierw któryś z rodziców trzymał za rączkę przymocowaną z tyłu rowerka, ale w którymś momencie po prostu ją puszczał. Niektóre dzieci jadą dalej samodzielnie, a inne przewracają się po kilku metrach. Tak samo jest z zarodkami. Jedne radzą sobie świetnie, inne dzielą się jeszcze najwyżej kilka razy i rozwój zostaje zahamowany. Dlatego transfer najlepiej wykonać już po tym etapie, kiedy mamy pewność, że zarodek dzieli się dalej prawidłowo. Czyja to wina, że zarodek nie pokonuje tego etapu? Nieprawidłowych komórek jajowych lub plemników? Samego zarodka? A może laboratorium? No cóż, jeśli dziecko przewraca się po kilku metrach na rowerku, czy to wina rodzica, dziecka, czy rowerka? Najrozsądniejsze będzie stwierdzenie, że dziecko nie jest gotowe do samodzielnej jazdy, że potrzebuje jeszcze wielu prób, kilku wskazówek od rodziców i dużo cierpliwości. Zarodek ma tylko jedną próbę, a wierzcie mi, aktywacja genomu to dużo bardziej skomplikowany proces, niż jazda na rowerze.
– diagnostyka przedimplantacyjna (jeśli jest stosowana) na tym etapie jest mniej wiarygodna. Pobieramy 1-2 komórki z zarodka i na ich podstawie trudniej jest ocenić status genetyczny zarodka w porównaniu z blastocystą, z której tych komórek możemy pobrać więcej (4-8). Poza tym, ze względów etycznych, wolimy nie pobierać komórek, które stanowią cenny materiał dla rozwijającego się płodu.
– biorąc pod uwagę zjawisko zatrzymania zarodka w rozwoju, częstą praktyką jest podawanie dwóch zarodków w dniu 3. To z kolei zwiększa ryzyko ciąży mnogiej, co może wiązać się z powikłaniami ciążowymi.
– transfer w dniu 3. to NIE jest „bardziej naturalne” podejście. Zarodek na etapie podziałów komórkowych, rozwija się w jajowodzie i wędruje w kierunku macicy. Dopiero gdy morula zaczyna przekształcać się w blastocystę, trafia do macicy. Zatem zarodek dwu- lub trzydniowy nie otrzyma w macicy substancji, które są mu potrzebne, bo trafił tam zbyt wcześnie. Istnieje ryzyko, że nie poradzi sobie w tym zmienionym środowisku.
Transfer w dniu 5. lub 6. zarodka w stadium blastocysty
Zalety:
– przedłużona hodowla umożliwia tzw. selekcję naturalną, podczas której zarodki słabej jakości, z wadami chromosomowymi, przestają się rozwijać i nie docierają do etapu blastocysty, a więc nie zostaną transferowane, ponieważ i tak nie miałyby szans na zagnieżdżenie.
– lepsze kryteria oceny morfologicznej blastocysty, pozwalają na wybór dobrej jakości zarodków do transferu i mrożenia. Dodatkowo, dzięki analizie morfokinetycznej podziałów zarodka w systemie time lapse, ocena potencjału zarodka jest jeszcze bardziej dokładna i trafna.
– dokonujemy oceny, transferu i mrożenia tylko zarodków, które przeszły aktywację genomu – tylko one są zdolne do dalszego rozwoju
– synchronizujemy rozwój zarodka z jego rozwojem w drogach rodnych kobiety – zarodki na etapie podziałów, do dnia 4. wędrują wzdłuż jajowodów. W laboratorium otrzymują dokładnie takie substancje, które są im potrzebne do produkcji energii i rozwoju, jakie dostałyby w naturze właśnie w jajowodach. W dniu 4. lub 5. zarodek trafia do macicy – na tym etapie ma inne zapotrzebowanie na substancje energetyczne. Transfer blastocysty jest odwzorowaniem tego, co dzieje się w naturze.
– minimalizujemy ekspozycję zarodka na środowisko w macicy, które jest zmienione pod wpływem stymulacji. Efekty podawania gonadotropin są jeszcze przez jakiś czas odczuwalne, zatem im krócej zarodek jest narażony na działanie leków, tym lepiej dla niego. Argument ten oczywiście nie dotyczy zarodków mrożonych.
– minimalizujemy ekspozycję zarodka na skurcze macicy zanim zostanie zaimplantowany. Zarodek 3-dniowy nie implantuje się od razu. Zanim osiągnie stadium blastocysty, w którym może uwolnić się z osłonki i zacząć proces zagnieżdżania, skurcze macicy mogą być dla niego bardzo niekorzystne.
– wyższy odsetek implantacji zarodków na tym etapie (choć istnieją też publikacje, według których zarówno odsetek implantacji, jak i ciąż klinicznych, jest podobny dla zarodków transferowanych w dniu 3. i 5., ale wszystko zależy od sposobu zaprojektowania badania, doboru próby badawczej i kontrolnej oraz wielkości próby badawczej. Poniżej zaprezentuję Wam dane z największej bazy Cochrane, która opracowuje dowody w oparciu o EBM – evidence based medicine. Moim zdaniem jest to najbardziej wiarygodne źródło wiedzy.)
– mniejsza liczba transferów potrzebnych do uzyskania ciąży – ocena zarodków w dniu 5. jest dużo bardziej „pewna” – możemy z większym prawdopodobieństwem ocenić potencjał implantacyjny zarodków
– w przypadku biopsji trofektodermy w celu przeprowadzenia diagnostyki przedimplantacyjnej – większa ilość uzyskanego materiału, bez naruszania węzła zarodkowego (z którego rozwija się płód)
– lepsza przeżywalność zarodków zamrożonych na etapie blastocysty
– zminimalizowanie ryzyka ciąży mnogiej dzięki transferom pojedynczych zarodków
– niektórzy sugerują, że dłuższa hodowla w laboratorium, może poprawić jakość słabszych zarodków, co może zwiększyć szansę na ciążę. Nie ma na to dowodów, dokładnie, jak z sytuacją odwrotną, w której warunki laboratoryjne miałyby osłabić zarodki w porównaniu do warunków w macicy, co opisałam już wcześniej.
Wady:
– wyższe koszty hodowli
– wysokie ryzyko odwołania transferu ze względu na brak blastocyst, szczególnie w cyklach, w których uzyskano niską ilość komórek jajowych.
– możliwe, że nawet genetycznie prawidłowe zarodki nie są w stanie dotrzeć do etapu blastocysty, jeśli warunki w laboratorium nie są dla zarodka odpowiednie (warunki hodowlane, jakość pożywki, środowisko rozwoju) – o tym wszystkim już pisałam, argument nie jest potwierdzony i nigdy nie będziemy mieć takiej pewności.
Skuteczność transferów
Tak, jak obiecałam, przytaczam wnioski pochodzące z bazy Cochrane. Zaznaczam, że wnioski te nie są jednoznaczne i bezsprzecznie pewne.
- Wskaźniki ciąż klinicznych i żywych urodzeń po transferach świeżych blastocyst, są wyższe od wskaźników po transferach zarodków blastomerowych. To oznacza, że po transferach w dniu 2. lub 3. uzyskujemy ok. 29% urodzeń, a po transferach w dn. 5. lub 6. między 32% a 42% żywych urodzeń.
- (Co najciekawsze) nie ma dowodów na istnienie jakichkolwiek różnic we wskaźnikach kumulatywnych (ze świeżych i mrożonych cykli).
Skomentuję drugi punkt, aby nieco rozjaśnić Wam, co to właściwie jest ta skuteczność kumulatywna. To ilość ciąż uzyskanych z jednego pobrania komórek. Załóżmy hipotetyczną sytuację, w której uzyskujemy 5 prawidłowych, dojrzałych komórek, z których rozwija się 5 zarodków w dniu 3., 2 blastocysty w dniu 5., a ostatecznie uzyskujemy jedną ciążę i rodzi się zdrowa dziewczynka. Niestety, pozostałe zamrożone i transferowane zarodki, nie dają nam rodzeństwa dla dziecka. Na poniższym, uproszczonym schemacie przedstawiłam tę hipotetyczną sytuację: zarodki w dniu 3. (górny rząd) oraz te same zarodki w dniu 5. (dolny rząd). „Szczęśliwy zarodek” zaznaczyłam kolorem różowym, a pozostałe, z których nie uzyskaliśmy ciąży, czerwonym. W przypadku założenia, że transfery wykonujemy na etapie dzielącego się zarodka złożonego z blastomerów (dzień 3.), do macicy transferowanych byłoby 5 zarodków (pojedynczo lub podwójnie, w kolejnych cyklach). W przypadku transferu blastocyst (dzień 5.), wykonalibyśmy tylko jeden transfer dwóch zarodków lub dwa transfery pojedynczych zarodków. Kumulatywny wskaźnik jest taki sam w obu przypadkach (bo kumulatywnie ze wszystkich zarodków uzyskaliśmy jedno dziecko). Natomiast skuteczność w przeliczeniu na transfer jest różna i wynosi w tej konkretnej sytuacji: w przypadku transferów w dn. 3. między 20 a 33%, a w przypadku transferów w dn. 5. między 50 a 100%.
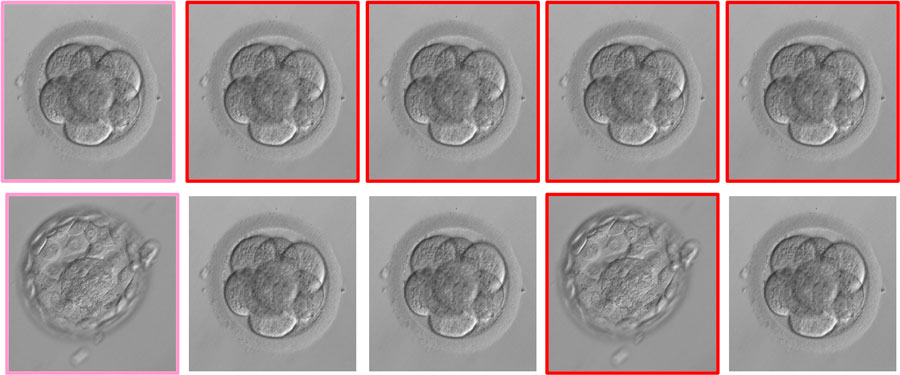
Górny rząd: zarodki w dniu 3., złożone z blastomerów. Dolny rząd: te same zarodki w dniu 5., na etapie blastocysty lub zatrzymane w rozwoju.
To, że według badań naukowych, nie ma różnic we wskaźnikach kumulatywnych dla transferów w dniu 3. i 5. jest więc dość logiczne. Możemy także wysnuć wnioski (mam nadzieję, że niezbyt daleko idące), że jednak środowisko laboratoryjne jest bardzo zbliżone do panującego w macicy, skoro kumulatywnie uzyskujemy podobną liczbę ciąż. Gdyby transfer w dniu 3. był dużo bardziej skuteczny, oznaczałoby to, że w macicy jednak jest zarodkom o wiele lepiej, bo te, które w laboratorium giną, po wcześniejszym transferze miałyby większe szanse.
Jak ocenić szanse zarodka?
Każdy zarodek na starcie ma takie same szanse na to, że rozwinie się i zagnieździ w macicy. Dlaczego? Bo tak naprawdę niczego o nim nie wiemy. Po prostu plemnik zapłodnił komórkę jajową i teraz wszystko już zależy od potencjału zarodka. Jeśli oglądaliście teleturniej „Jeden z dziesięciu” to szanse każdego z 10 zawodników, na początku programu są takie same. Każdy ma możliwość wygranej – jeśli wygraną ocenimy jako 100%, to nie znając uczestników, nie wiedząc, jak radzą sobie w warunkach stresowych i jak rozległą wiedzę posiadają, możemy dać im w teorii po 10% szans na wygraną. Później, w miarę rozwoju sytuacji, na prowadzenie wysuwają się najlepsi. A do finału trafia trójka zawodników. W finale, w teorii, każdy na początku ma ok. 33% szans na wygraną, bo mają już mniej rywali. Dlaczego ten sam człowiek 15 minut temu miał 10% szans, a teraz ma już 33%? To wciąż ten sam zawodnik. Dlaczego nie daliśmy mu tych 33% na początku programu? Bo go nie znaliśmy. Nie wiedzieliśmy o nim zbyt wiele. Ale załóżmy, że w teleturnieju bierze udział nasz kolega, który już od podstawówki był prymusem, potem wygrywał różne konkursy i ma rozległą wiedzę w różnych dziedzinach. Czy na samym początku nie dalibyśmy mu większego kredytu zaufania? Czy nie obstawialibyśmy go, jak czarnego konia na wyścigach, czy nie założylibyśmy się z kumplami, że to on wygra? Niestety, jeśli mamy do czynienia z zarodkami, nie wiemy, który będzie „czarnym koniem”. Dzięki obserwacji wczesnych podziałów zarodka w inkubatorze time lapse, możemy zauważyć, który z nich jest lepszy, a który słabszy. Ale i tak nie mamy stuprocentowej pewności, że wszystko będzie z nim dobrze. Może rozwijać się prawidłowo do dnia 3., ale później nagle zatrzymać się i przestać dzielić. Może rozwinąć się w blastocystę, ale bardzo słabej jakości, z oznakami degeneracji. Dlatego każdy zarodek, jak uczestnicy teleturnieju, ma jednakowe szanse na starcie. W 5. dniu, kiedy zarodki osiągną stadium blastocysty, te szanse są wyższe. I może się okazać, że zarodek, który miał 10% szans, aktualnie ma 30-40%. To nie oznacza, że był słaby, a teraz jest silniejszy. To oznacza, że nie znaliśmy jego potencjału, jego możliwości, a teraz wiemy o nim więcej. Podsumowując – transfer w dniu 5. wynika z niewiedzy (oj tak…) oraz najlepszej praktyki, która ma na celu zminimalizowanie ilości transferów. Co więcej – zupełnie inaczej, jak w teleturnieju „Jeden z dziesięciu”, w przypadku zabiegu in vitro, może nie być żadnego zwycięzcy…
Może to okrutne, że czekamy 5 dni, aby na końcu okazało się, że transfer jest odwołany. Ale spójrzcie na to w inny sposób. Kilka nieudanych transferów w dniu trzecim, to strata czasu, przy dokładnie takim samym braku efektów, jak odwołanie transferu w dniu piątym. Dzięki przedłużonej hodowli, pacjenci zyskują czas, pieniądze oraz oszczędzają sobie mnóstwo nerwów, oczekiwania na wynik testu beta HCG oraz wylanych łez. Możemy za to wyciągnąć wnioski i działać dalej, być może w nieco innym kierunku. Moim zdaniem ta opcja, choć bardzo przykra, smutna i odbierająca nadzieję, jest jednocześnie tą, która daje coś cenniejszego – czas.
ANETA MACUR
Dowiedz się więcej czytając nasze artykuły






