Czy moje dziecko będzie zdrowe, czyli jak badamy zarodki część 2.
W poprzednim wpisie Czy moje dziecko bedzie zdrowe czyli jak badamy zarodki omówiłam rodzaje diagnostyki przedimplantacyjnej, wskazania oraz warunki, jakie trzeba spełnić, aby do niej przystąpić. Dziś zaproszę Was do laboratorium i poznacie nieco więcej szczegółów. Zapraszam!
Techniki biopsji
Aby zbadać zarodek, musimy pobrać materiał do diagnostyki. Materiał można pobrać na różnych etapach:
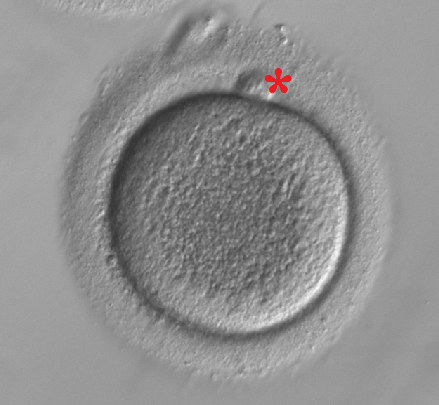
1. Biopsja ciałka kierunkowego (poniżej na zdjęciu oznaczone czerwoną gwiazdką) – umożliwia diagnostykę nie zarodka, ale komórki jajowej. Komórka jajowa, która dojrzewa, podlega podziałom (ze szkoły być może pamiętacie termin „mejoza”). W czasie tych podziałów, wyrzuca zbędny materiał genetyczny na zewnątrz, w postaci małej komórki – tzw. ciałka kierunkowego. I właśnie to ciałko kierunkowe możemy pobrać do badania i sprawdzić, czy zawiera dokładnie połowę chromosomów „wyrzuconych” z komórki jajowej. Wyobraźmy sobie, że zaglądamy do kosza na śmieci, widzimy skórkę z banana i na tej podstawie wiemy, że na podwieczorek ktoś zjadł banana. Ciałko kierunkowe nie zawiera natomiast w ogóle materiału genetycznego pochodzącego od ojca, więc zarodek, który powstanie z takiego przebadanego genetycznie, prawidłowego oocytu, może posiadać wady wniesione przez plemnik lub wynikające z nieprawidłowych podziałów mitotycznych samego zarodka. Wracając do skórki z banana – wiemy, że ktoś zjadł banana, ale w jakiej postaci? Może to były naleśniki z bananem, może sałatka, a może galaretka? Nie znamy dalszych losów tego banana – ktoś go obrał, ale nie wiemy, jak go przyrządził. Metoda jest zatem ograniczona do zbadania mutacji pochodzących wyłącznie od matki. Ponadto, nie wszystkie komórki jajowe ulegają zapłodnieniu i rozwijają się do stadium zarodka (a diagnostyka jest dość kosztowna). Oczywiście są też plusy – ciałko kierunkowe jest zbędnym produktem podziału mejotycznego, więc z przyczyn etycznych jest to metoda najmniej ingerująca w sam rozwój zarodka.
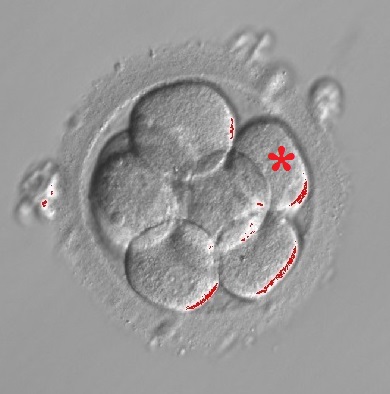
2. Biopsja blastomerów – biopsję wykonuje się na zarodkach 3-dniowych, w stadium bruzdkowania. Prościej mówiąc, zarodek składa się wówczas z kilku komórek, z których pobieramy najczęściej jedną. Oczywiście akurat ta jedna pobrana komórka nie zawsze odzwierciedla faktyczny status genetyczny całego zarodka (może być nie reprezentatywna w stosunku do reszty komórek). Nazywamy to mozaicyzmem – blastomery mogą różnić się między sobą i nawet, jeśli ten jeden zawiera nieprawidłowości, to nie znaczy, że wszystkie je posiadają (i odwrotnie – gdy jeden blastomer jest prawidłowy, istnieje ryzyko, że reszta ma wady genetyczne). Przy aktualnym stanie wiedzy embriologicznej, biopsja na tym etapie nie jest efektywna i niestety może prowadzić do błędów diagnostycznych. Nie powinna być też stosowana ze względu na negatywny wpływ na żywotność i potencjał implantacyjny zarodka.
3. Biopsja trofektodermy – pobranie kilku komórek trofektodermy w stadium blastocysty. Trofektoderma to komórki warstwy zewnętrznej zarodka, z których w dalszym rozwoju powstaje łożysko. Wygląda ona trochę jak maleńka piłka nożna 🙂 Trofektoderma otacza jamę blastocysty wypełnioną płynem i niewielki węzeł zarodkowy, z którego rozwija się płód. Zarodek, który chcemy zdiagnozować, jest hodowany standardowo do dnia 5. lub 6. Wówczas powinien osiągnąć stadium blastocysty – to w tym stadium rozwojowym następuje badanie zarodka.
Wszystkie embriony, którym nie udało się dotrzeć do tego etapu, które zatrzymały się w rozwoju lub zdegenerowały wcześniej, zostają odrzucone z hodowli.
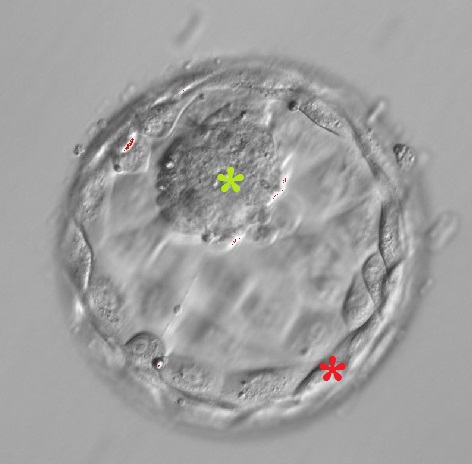
Po lewej: blastocysta zbudowana z węzła zarodkowego (zielona gwiazdka) i trofektodermy (czerwona gwiazdka). Blastocystę, a w szczególności trofektodermę, można porównać kształtem do piłki nożnej.
Czy to bezpieczne, czyli jak przebiega biopsja trofektodermy?
Zawsze, gdy chcemy wykonać biopsję (ciałka kierunkowego, blastomeru lub trofektodermy), pierwszym etapem jest wykonanie otworu w osłonce otaczającej oocyt lub zarodek. Otwór wykonuje się laserowo, uważając przy tym, aby nie uszkodzić zarodka lub komórki jajowej.
Z zarodka, który podlega diagnostyce przedimplantacyjnej, embriolog pobiera w sposób inwazyjny za pomocą igły, kilka komórek trofektodermy. To tak, jakby wyciąć dziurę w piłce.
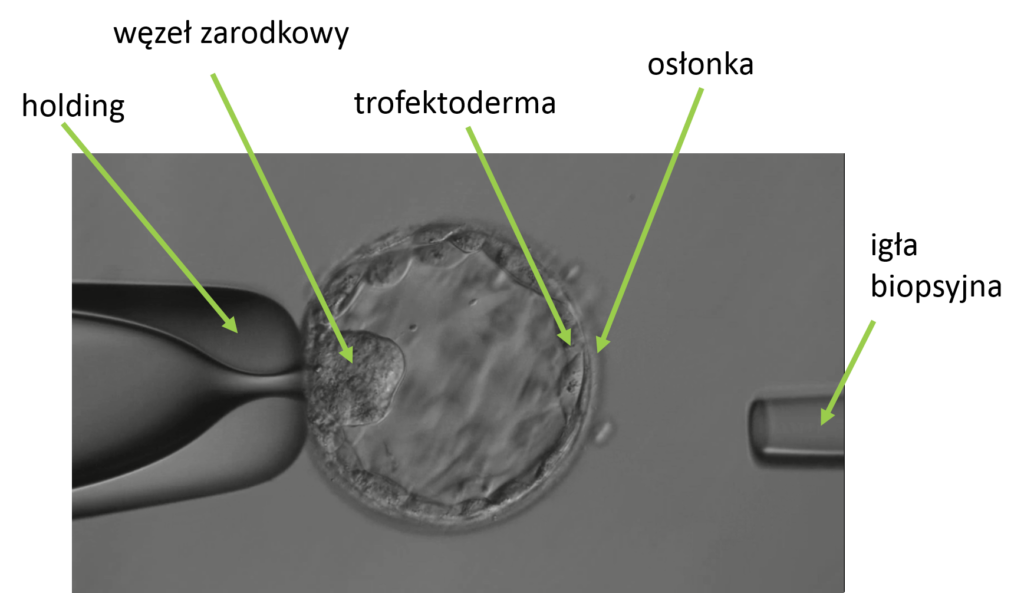
Po pobraniu komórek, zarodek umieszczany jest ponownie w inkubatorze. Zarodki, które przeżyły biopsję trofektodermy, zostają zamrożone, a materiał wysyłamy wówczas do badania. Wyniki badań genetycznych zarodka są dostępne po około 4-6 tygodniach.
Z czym wiąże się ryzyko w czasie diagnostyki przedimplantacyjnej?
Przede wszystkim należy pamiętać, że diagnostyka przedimplantacyjna to nie bułka z masłem. Między innymi z tego powodu konieczne są wskazania do jej zastosowania i nie można jej wykonać „na życzenie pacjenta”. Jest wiele etapów i każdy z nich wiąże się z pewnym ryzykiem:
- Osiągnięcie przez zarodek stadium blastocysty – nie każda komórka jajowa się zapłodni, a część zarodków zatrzymuje się w trakcie rozwoju, zatem u pacjentów, u których istnieje zwiększone ryzyko wystąpienia wad genetycznych u potomstwa, część zarodków po prostu nie dotrwa do dnia 5. (również dlatego, że wady genetyczne mogą manifestować się już na etapie pierwszych podziałów i doprowadzić do degeneracji zarodka).
- Pobranie materiału do badania jest procedurą inwazyjną – embriolog odcina kilka komórek i powstaje ubytek w zarodku, który tak jak rana u dorosłego człowieka, musi się „wygoić”. Blastocysta ma bardzo duży potencjał do podziałów i naprawiania tego typu ubytków, więc w większości zarodki świetnie sobie radzą. Ryzyko, że blastocysta zdegeneruje w wyniku biopsji jest niewielkie, wynosi kilka procent, ale pamiętajmy, że gdyby nie badanie genetyczne, to ryzyko by nie istniało.
- Zamrożenie zarodka – niektóre zarodki, szczególnie te o słabym potencjale rozwojowym, mogą nie poradzić sobie z przetrwaniem procesu zamrażania i rozmrażania. Tutaj znowu ryzyko jest bardzo niewielkie i wynosi 1-2%.
- Istnieje możliwość, że zarodek, na którym wykonano biopsję trofektodermy, uzyskuje niediagnostyczny wynik badania genetycznego. Oznacza to, że nie udało się w sposób wiarygodny uzyskać jednoznacznego wyniku. Wówczas konieczna jest rebiopsja, czyli zarodek jest ponownie rozmrażany, dokonywana jest powtórna biopsja komórek i zarodek jest mrożony w oczekiwaniu na kolejny wynik. To niesie ze sobą kumulatywne ryzyko wynikające ze wszystkich przeprowadzanych procedur.
- Pomimo uzyskanego wyniku diagnostyki przedimplantacyjnej, możemy mieć do czynienia z mozaicyzmem, o którym wspominałam już wcześniej (występuje u poniżej 7% blastocyst) – zbadane komórki mogą być prawidłowe, podczas, gdy faktycznie zarodek posiada wady genetyczne, lub odwrotnie, w komórkach trofektodermy wykryto mutacje, ale węzeł zarodkowy jest od nich wolny. Wady genetyczne mogą także powstać już po piątym dniu rozwoju zarodka – czyli później niż pobierana jest próbka do badania. Ponadto wykonując diagnostykę screeningową (PGT-A) nie wykryjemy niewielkich wad genetycznych, które w zarodku mogą być obecne, a przy diagnostyce PGT-M i PGT-SR, skupiamy się na pojedynczej mutacji, nie na badaniu całego kariotypu. Z wyżej wymienionych powodów, diagnostyka przedimplantacyjna nie daje nam stuprocentowej pewności, że dziecko będzie zdrowe, dlatego tak ważne jest wykonanie badań prenatalnych w czasie ciąży.
Jak zminimalizować ryzyko?
- Jeśli zarodek, a szczególnie trofektoderma jest słabej jakości, najbezpieczniejsze dla zarodka będzie odstąpienie od biopsji i zamrożenie go bez diagnostyki. Zwykle w takich przypadkach embriolog ocenia ryzyko i konsultuje się z pacjentami. Kierujemy się zasadą: po pierwsze – nie szkodzić.
- Hodowla zarodków powinna przebiegać w systemie time-lapse, aby embriolog mógł ustalić odpowiedni moment do pobrania komórek z zarodka, a następnie obserwować zarodek po biopsji. W hodowli time-lapse widoczne są także zaburzenia rozwoju morfokinetycznego, a więc ocena potencjału blastocysty jest dużo bardziej dokładna.
- Im więcej komórek pobranych do badania, tym mniejsze ryzyko mozaicyzmu, zatem blastocysta powinna mieć jak najlepszą trofektodermę. A jak wiemy, dobrej jakości zarodki powstają z dobrej jakości komórek jajowych i plemników. Zatem należy zadbać o suplementację i zdrowy styl życia przed zabiegiem oraz wybór najlepszych plemników do zapłodnienia np. poprzez zastosowanie metod selekcji nasienia.
- Wspominałam już, że biopsja trofektodermy jest zabiegiem inwazyjnym i trudnym technicznie. Powinien ją wykonywać wyłącznie embriolog z doświadczeniem!!! który uczestniczył w kursach w tym zakresie. Najlepiej, jeśli jego umiejętności zostaną potwierdzone certyfikatem. Sama wiem, że najwięcej nauczyłam się właśnie na zagranicznych kursach oraz poprzez praktykę i wiele godzin ćwiczeń – z książek można zdobyć wiedzę, ale nad techniką trzeba długo pracować.
- Zwróćcie też uwagę, jaką metodą przeprowadzane jest samo badanie genetyczne. Obecnie najbardziej zaawansowaną metodą jest NGS (ang. Next-Generation Sequencing), czyli sekwencjonowanie nowej generacji. Metody CGH czy FISH należą już raczej do przeszłości.
- Pisałam, że biopsja trofektodermy jest obecnie metodą najczęściej stosowaną, ze względu na możliwość uzyskania większej ilości komórek (4-8) przy zminimalizowaniu ryzyka mozaicyzmu. Daje najbardziej wiarygodną informację na temat zarodka, jaką przy obecnym stanie wiedzy jesteśmy w stanie uzyskać. Inne metody biopsji (ciałka kierunkowego, blastomerów) są dużo bardziej kosztowne, bo tylko 50% zarodków dociera do stadium blastocysty, a więc badane są komórki i zarodki, z których część po prostu przestanie się rozwijać lub zdegeneruje jeszcze przed podaniem do macicy. Uzyskujemy też minimalną ilość materiału genetycznego, która może nie być wiarygodna i reprezentatywna. Dzięki biopsji trofektodermy uzyskujemy informacje na temat mutacji genetycznych pochodzenia matczynego, ojcowskiego oraz wynikających z podziałów zarodka. I wreszcie, sama biopsja nie wpływa negatywnie na dalszy rozwój zarodka, co może mieć miejsce w przypadku zarodka 3-dniowego.
Koszty badań genetycznych
Niestety, koszty diagnostyki przedimplantacyjnej są dość wysokie i dostosowane indywidualnie do ilości badanych zarodków. Orientacyjnie – koszty samej diagnostyki PGD-A, czyli screening genomu zarodka pod kątem dużych mutacji chromosomowych to cena kilku tysięcy złotych. Jeśli badamy zarodek pod kątem konkretnej mutacji, której nosicielem jest jeden z rodziców, koszty zależą od rodzaju mutacji i mogą wynieść nawet kilkanaście tysięcy złotych. Oczywiście ceny różnią się w zależności od kliniki i laboratorium genetycznego.

Dowiedz się więcej czytając nasze artykuły